تعلن BeiGene عن النتائج المالية وتحديثات الأعمال للربع الرابع والعام الكامل لعام 2023
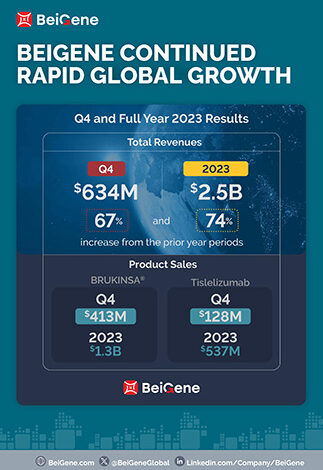
- استمرار النمو العالمي السريع بإيرادات إجمالية قياسية بلغت 634 مليون دولار في الربع الرابع و2.5 مليار دولار في عام 2023 بأكمله، بزيادة قدرها 67% و74% عن فترات السنوات السابقة
- تعزيز الريادة في أدوية أمراض الدم من خلال مبيعات BRUKINSA® (زانبروتينيب) العالمية التي تبلغ 413 مليون دولار أمريكي و1.3 مليار دولار أمريكي للربع سنة والعام بأكمله، بزيادة قدرها 135% و129%
- خط إمدادات مبتكر ومتقدم لأمراض الدم مع بدء أربع تجارب تسجيلية لسونروتوكلاكس، بما في ذلك دراسة المرحلة الثالثة العالمية في علاج مرضى سرطان الدم الليمفاوي المزمن الذين لم يسبق لهم تلقي العلاج، ومجموعتا توسع عالميتان لبروتون تيروزين كيناز (BTK) الذي يستهدف مركب تنشيط التحلل الكيميائي (CDAC) في سرطان الدم الليمفاوي المزمن المنتكس أو المقاوم وسرطان الغدد الليمفاوية للخلية القشرية المنتكس أو المقاوم
- نمو مستدام مع مزيج متنوع من المنتجات والإيرادات الجغرافية وتحسين الرافعة التشغيلية
أعلنت شركة .BeiGene, Ltd (المدرجة في بورصة ناسداك تحت الرمز:BGNE وبورصة هونج كونج تحت الرمز: 06160؛ ,بورصة سنغافورة تحت الرمز: 688235)، وهي شركة عالمية لعلم الأورام، اليوم توسعها العالمي المستمر، ونمو الإيرادات العالمي والأمريكي السريع، وإستراتيجية البحث والتطوير المبتكرة مع عرض نتائج الربع الرابع وعام 2023 بأكمله وأبرز الأعمال.
قال John V. Oyler، رئيس مجلس الإدارة والمؤسس المشارك والرئيس التنفيذي لشركة BeiGene: “حققنا في BeiGene تقدمًا كبيرًا في الربع الرابع وعام 2023 بأكمله نحو هدفنا المتمثل في أن نصبح مبتكرين مؤثرين في علم الأورام من الجيل التالي. لقد عززنا ريادتنا في مجال أمراض الدم من خلال النجاح المستمر لإطلاق عقار بروكينسا العالمي، بقيادة الولايات المتحدة وأوروبا”. “مكنتنا أبحاثنا وتطويرنا وتصنيعنا المتميز من حيث التكلفة من بناء واحدة من أكبر خطوط تصنيع عقارات الأورام وأكثرها تطورًا في هذه الصناعة. نحن نتطلع إلى عام تحويلي لشركة BeiGene حيث نواصل تقديم التميز التشغيلي مدفوعًا بالنمو المتميز في الإيرادات عبر المناطق الجغرافية الجديدة والحالية”.
النقاط الرئيسية للأعمال وخطوط الإمدادات
- بلغت إيرادات المنتجات لهذا الربع 630.5 مليون دولار أمريكي، وللعام بأكمله 2.2 مليار دولار أمريكي، بزيادة 86% و75% عن إجمالي العام السابق؛
- أدت الإدارة المنضبطة لنمو نفقات التشغيل إلى انخفاض خسائر التشغيل بنسبة 18% و33% على أساس مبادئ المحاسبة المقبولة عموماً و28% و47% على أساس معدل لربع السنة والعام بأكمله؛
- تم ترسيخ مكانة بروكينسا كمثبط BTK المفضل مع موافقة إدارة الغذاء والدواء الأمريكية (FDA) على تحديث الملصق ليشمل نتائج البقاء على قيد الحياة الخالية من التقدم (PFS) في متابعة متوسطة تبلغ 29.6 شهرًا من تجربة المرحلة 3 ALPINE التي تقارن بروكينسا مع IMBRUVICA® (إبروتينيب) في المرضى الذين عولجوا سابقًا والذين يعانون من سرطان الدم الليمفاوي المزمن المنتكس أو المقاوم؛
- التسمية العالمية الموسعة لبروكينسا بموافقة المفوضية الأوروبية لعلاج المرضى البالغين الذين يعانون من سرطان الغدد الليمفاوية الجريبي المنتكس أو المقاوم الذين تلقوا علاجين منهجيين سابقين على الأقل، مما يجعله أول مثبط BTK معتمد على الإطلاق في هذا المؤشر ومثبط BTK ذا التصنيف الأوسع في تلك الفئة؛
- ظهرت الريادة في مجال أمراض الدم وقوة خط إنتاج الشركة من خلال 25 ملخصًا تم تقديمها في الاجتماع السنوي للجمعية الأمريكية لأمراض الدم (ASH) في ديسمبر، بما في ذلك:
- نتائج محدثة من تجربة ALPINE تظهر تفوقًا مستدامًا في ما يتعلق بفترة الحياة الخالية من التقدم في متوسط متابعة 39 شهرًا لعقار بروكينسا مقارنة مع إمبروفيكا لعلاج المرضى البالغين المصابين بسرطان الدم الليمفاوي المزمن المنتكس أو المقاوم؛
- بيانات المرحلة 1/2 من تجربة سونروتوكلاكس التي تثبت السلامة والتحمل بالاشتراك مع بروكينسا مع استجابات عميقة ودائمة في علاج مرضى سرطان الدم الليمفاوي المزمن الذين لم يسبق لهم تلقي العلاج؛ ونشاط واعد لعامل واحد في المرضى الذين يعانون من سرطان الغدد الليمفاوية في المنطقة الهامشية المقاوم أو المنتكس؛ وفعالية وسلامة واعدة بالاشتراك مع الديكساميثازون في المايلوما المتعددة (MM) مع t(11,14)؛
- تُظهر البيانات البشرية الأولى لـ BTK CDAC BGB-16673 استجابات سريرية ملحوظة وملامح أمان مقبولة لدى المرضى الذين تم علاجهم بشكل كبير والذين يعانون من أورام خبيثة في الخلايا B، بما في ذلك المرضى الذين يعانون من مرض مقاوم لـ BTKi.
- توسيع التأثير العالمي للأجسام المضادة لـ PD -1 TEVIMBRA® (تيسليزوماب) مع رأي إيجابي من مجلس المنتجات الطبية ذات الاستخدام البشري (CHMP) التابعة لوكالة الأدوية الأوروبية (EMA) التي توصي بالموافقة كعلاج للحالات غير الصغيرة لسرطان خلايا الرئة (NSCLC) عبر ثلاثة مؤشرات، وقبول وكالة الأدوية الأوروبية لتقديم علاج للمرضى البالغين المصابين بسرطان الخلايا الحرشفية المريئي من الخط الأول (ESCC)، والمراجعات التنظيمية الجارية في 10 أسواق، بما في ذلك الولايات المتحدة وأوروبا؛
- إستراتيجية بحث وتطوير مبتكرة متقدمة من خلال إدخال خمسة كيانات جزيئية جديدة (NMEs) إلى العيادة في عام 2023، بما في ذلك مثبط CDK4 الأفضل في فئته BGB-43395.
أبرز النتائج المالية للربع الرابع وسنة 2023 بالكامل
إيرادات الربع الرابع وسنة 2023 بالكامل بلغت 634.4 مليون دولار و2.5 مليار دولار على التوالي، مقارنة بـ 380.1 مليون دولار و1.4 مليار دولار في فترات السنوات السابقة. تُعزى الزيادة في إجمالي الإيرادات في ربع السنة مقارنة بالعام السابق في المقام الأول إلى نمو مبيعات المنتجات في الأسواق الرئيسية للشركة. بالنسبة للربع الرابع وعام 2023 بأكمله، كانت الولايات المتحدة أكبر سوق حصلت الشركة على إيرادات منه، حيث بلغت الإيرادات 313.2 مليون دولار و1.1 مليار دولار، على التوالي، مقارنة بـ 155.4 مليون دولار و502.6 مليون دولار في فترات السنوات السابقة. تتوقع الشركة أن يستمر هذا الاتجاه في عام 2024 مع استمرار نمو مبيعات الولايات المتحدة من بروكينسا.
|
|
|
ثلاثة أشهر تنتهي في 31 ديسمبر، |
|
اثنا عشر شهرًا تنتهي في 31 ديسمبر، |
||||||||
|
(بالآلاف، باستثناء مبالغ السهم) |
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
صافي إيرادات المنتج |
|
$ |
630,526 |
|
$ |
339,022 |
|
$ |
2,189,852 |
|
$ |
1,254,612 |
|
صافي الإيرادات من التعاون |
|
$ |
3,883 |
|
$ |
41,073 |
|
$ |
268,927 |
|
$ |
161,309 |
|
إجمالي الإيرادات |
|
$ |
634,409 |
|
$ |
380,095 |
|
$ |
2,458,779 |
|
$ |
1,415,921 |
|
|
|
|
|
|
|
|
|
|
||||
|
الخسارة المتوافقة مع مبادئ المحاسبة المقبولة عمومًا من العمليات |
|
$ |
(383,795) |
|
$ |
(468,622) |
|
$ |
(1,207,736) |
|
$ |
(1,789,665) |
|
الخسارة المعدلة من العمليات* |
|
$ |
(267,224) |
|
$ |
(372,480) |
|
$ |
(752,473) |
|
$ |
(1,420,225) |
|
|
|
|
|
|
|
|
|
|
||||
|
* للحصول على شرح لاستخدامنا للتدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عموماً، راجع قسم “استخدام التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عموماً” لاحقًا في هذا البيان الصحفي ولمطابقة كل تدبير مالي غير متوافق مع مبادئ المحاسبة المقبولة عموماً مع أكثر تدابير مبادئ المحاسبة المقبولة عموماً القابلة للمقارنة، انظر الجدول في نهاية هذا البيان الصحفي. |
||||||||||||
بلغ إجمالي إيرادات المنتج 630.5 مليون دولار و2.2 مليار دولار للربع الرابع وسنة 2023 بأكملها، على التوالي، مقارنة بـ 339.0 مليون دولار و1.3 مليار دولار في فترات السنوات السابقة، وتشمل:
- بلغت المبيعات العالمية لعقار بروكينسا 413.0 مليون دولار أمريكي و1.3 مليار دولار أمريكي للربع الرابع وعام 2023 بأكمله، على التوالي، مقارنة بـ 176.1 مليون دولار أمريكي و564.7 مليون دولار أمريكي في فترتي العام السابق؛
- بلغت مبيعات تيسليزوماب 128.0 مليون دولار أمريكي و536.6 مليون دولار أمريكي للربع الرابع وعام 2023 بأكمله، على التوالي، مقارنة بـ 102.2 مليون دولار أمريكي و422.9 مليون دولار أمريكي في فترتي العام السابق؛
- بلغت مبيعات منتجات Amgen المرخصة 51.1 مليون دولار و188.3 مليون دولار للربع الرابع وسنة 2023 بأكملها على التوالي، مقارنة بـ 27.7 مليون دولار و114.6 مليون دولار في فترات السنوات السابقة.
بلغ الهامش الإجمالي كنسبة مئوية من مبيعات المنتجات العالمية للربع الرابع وعام 2023 بأكملها 83.2% و82.7% على التوالي، مقارنة بـ 78.3% و77.2% في فترات السنوات السابقة. زادت نسبة الهامش الإجمالي في كل من الربع السنوي والفترة السنوية بسبب مزيج مبيعات المنتجات الأعلى نسبيًا من بروكينسا العالمية مقارنة بالمنتجات الأخرى في محفظتنا ومقارنتها بالمنتجات ذات الهامش المنخفض في المنتجات المرخصة، بالإضافة إلى انخفاض التكاليف لكل وحدة لكل من بروكينسا وتيسليزوماب.
نفقات التشغيل
يلخص الجدول التالي المصاريف التشغيلية للربع الرابع في 2023 و2022 على التوالي:
|
|
|
المتوافقة مع مبادئ المحاسبة المقبولة عمومًا |
|
|
|
غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا |
|
|
||||||||
|
(بالآلاف، باستثناء النسب المئوية) |
|
الربع الرابع 2023 |
|
الربع الرابع 2022 |
|
% التغيير |
|
الربع الرابع 2023 |
|
الربع الرابع 2022 |
|
% التغيير |
||||
|
البحث والتطوير |
|
$ |
493,987 |
|
$ |
446,023 |
|
%11 |
|
$ |
437,383 |
|
$ |
404,186 |
|
%8 |
|
البيع العام والإداري |
|
$ |
416,547 |
|
$ |
328,984 |
|
%27 |
|
$ |
361,435 |
|
$ |
275,648 |
|
%31 |
|
الاستهلاك(1) |
|
$ |
1,838 |
|
$ |
188 |
|
%878 |
|
$ |
— |
|
$ |
— |
|
NM |
|
إجمالي نفقات التشغيل |
|
$ |
912,372 |
|
$ |
775,195 |
|
%18 |
|
$ |
798,818 |
|
$ |
679,834 |
|
%18 |
يلخص الجدول التالي نفقات التشغيل للعامين 2023 و2022 بالكامل على التوالي:
|
|
|
المتوافقة مع مبادئ المحاسبة المقبولة عمومًا |
|
|
|
غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا |
|
|
||||||||
|
(بالآلاف، باستثناء النسب المئوية) |
|
السنة المالية 2023 |
|
السنة المالية 2022 |
|
% التغيير |
|
السنة المالية 2023 |
|
السنة المالية 2022 |
|
% التغيير |
||||
|
البحث والتطوير |
|
$ |
1,778,594 |
|
$ |
1,640,508 |
|
%8 |
|
$ |
1,558,960 |
|
$ |
1,474,919 |
|
%6 |
|
البيع العام والإداري |
|
$ |
1,504,501 |
|
$ |
1,277,852 |
|
%18 |
|
$ |
1,284,689 |
|
$ |
1,077,977 |
|
%19 |
|
الاستهلاك (1) |
|
$ |
3,500 |
|
$ |
751 |
|
%366 |
|
$ |
— |
|
$ |
— |
|
NM |
|
إجمالي نفقات التشغيل |
|
$ |
3,286,595 |
|
$ |
2,919,111 |
|
%13 |
|
$ |
2,843,649 |
|
$ |
2,552,896 |
|
%11 |
|
|
||||||||||||||||
|
(1) يتعلق بالأصول غير الملموسة لحقوق توزيع منتجات BMS والتي تم استهلاكها بالكامل اعتبارًا من 31 ديسمبر 2023، عندما عادت الحقوق مرة أخرى إلى BMS بموجب شروط اتفاقية التسوية. |
||||||||||||||||
زادت نفقات البحث والتطوير للربع الرابع والعام 2023 بأكمله مقارنة بفترات العام السابق على كل من مبادئ المحاسبة المقبولة عمومًا والأساس المعدل ويرجع ذلك في المقام الأول إلى الاستثمار في منصات/طرق جديدة لتطوير برامج ما قبل السريرية في العيادة والبرامج السريرية المبكرة إلى مرحلة متأخرة. بلغ إجمالي الرسوم المسبقة المتعلقة بالبحث والتطوير الجاري للأصول المرخصة 31.8 مليون دولار و46.8 مليون دولار في الربع الرابع وعام 2023 بأكمله على التوالي، مقارنة بـ 48.7 مليون دولار و68.7 مليون دولار في فترات السنوات السابقة.
ارتفعت نفقات البيع العامة والإدارية للربع الرابع وعام 2023 بأكمله مقارنة بفترات السنة السابقة على أساس مبادئ المحاسبة المقبولة عمومًا والمعدلة بسبب استمرار الاستثمار في الإطلاق التجاري العالمي لبروكينسا في المقام الأول في الولايات المتحدة وأوروبا.
صافي الخسارة
تحسن صافي الخسارة المتوافقة مع مبادئ المحاسبة المقبولة عمومًا للربع الرابع والعام بأكمله 2023، مقارنة بفترات العام السابق، ويعزى ذلك في المقام الأول إلى انخفاض الخسائر التشغيلية والمكاسب غير التشغيلية البالغة 362.9 مليون دولار أمريكي المتعلقة بتسوية التحكيم لـ BMS للعام 2023 بأكمله.
بالنسبة للربع الرابع من عام 2023، بلغ صافي خسارة السهم 0.27 دولار للسهم و3.53 دولارات لكل سهم إيداع أمريكي، مقارنة بـ 0.33 دولار للسهم و4.29 دولارات لكل سهم إيداع أمريكي في فترة السنة السابقة. بلغ صافي الخسارة لعام 2023 بأكمله 0.65 دولار للسهم الواحد و8.45 دولارات لكل سهم إيداع أمريكي، مقارنة بـ 1.49 دولار للسهم الواحد و19.43 دولارًا لكل سهم إيداع أمريكي في فترة العام السابق.
|
النقد وما يعادله والنقد المقيد |
||||
|
|
السنة المنتهية في 31 ديسمبر، |
|||
|
|
|
2023 |
|
2022 |
|
|
(بالآلاف) |
|||
|
النقد وما يعادله والنقد المقيد في بداية الفترة |
$ |
3,875,037 |
$ |
4,382,887 |
|
صافي النقد المستخدم في الأنشطة التشغيلية |
|
(1,157,453) |
|
(1,496,619) |
|
صافي النقد المقدم من الأنشطة الاستثمارية |
|
60,004 |
|
1,077,123 |
|
صافي النقد المقدم من (المستخدم في) أنشطة التمويل |
|
416,478 |
|
(18,971) |
|
الأثر الصافي لتغيرات أسعار صرف العملات الأجنبية |
|
(8,082) |
|
(69,383) |
|
صافي النقص في النقد وما يعادله والنقد المقيد |
|
(689,053) |
|
(507,850) |
|
النقد وما يعادله والنقد المقيد في نهاية الفترة |
$ |
3,185,984 |
$ |
3,875,037 |
|
|
||||
بلغ النقد المستخدم في العمليات في الربع الرابع وعام 2023 بالكامل 221.6 مليون دولار و1.2 مليار دولار على التوالي، مقارنة بـ 318.2 مليون دولار و1.5 مليار دولار في فترات السنوات السابقة، مدفوعًا بتحسين الرافعة المالية التشغيلية.
لمزيد من التفاصيل حول البيانات المالية لشركة BeiGene لعام 2023، يرجى الاطلاع على تقرير BeiGene السنوي في النموذج 10-K لعام 2023 المقدم إلى لجنة الأوراق المالية والبورصات الأمريكية.
برامج التقدم والتطوير التنظيمية
أبرز النقاط
- تم تعزيز استخدام بروكينسا كمثبط BTK المفضل مع تحديث علامة التفوق PFS من إدارة الغذاء والدواء الأمريكية، والموافقات لاستخدامه مع سرطان الغدد الليمفاوية الجريبي المنتكس أو المقاوم في أوروبا وكندا
- الوصول العالمي الموسع لعقار تيفيمبرا مع تقديمات تنظيمية معلقة في 10 أسواق، بما في ذلك الولايات المتحدة وأوروبا
- تم تسجيل المرضى الأوائل في المرحلة الثالثة من التجربة العالمية لعقار سونروتوكلاكس في مسار العلاج الأول لسرطان الدم الليمفاوي المزمن ومجموعات التوسع مع إمكانية التسجيل لبروتون تيروزين كيناز (BTK) الذي يستهدف مركب تنشيط التحلل الكيميائي (CDAC)
|
الفئة |
الأصل |
المعالم الأخيرة |
|
الموافقات التنظيمية |
بروكينسا |
|
|
تيفيمبرا |
|
|
|
التقديمات التنظيمية |
تيسليزوماب |
|
|
الأنشطة السريرية |
بروكينسا |
|
|
تيسليزوماب |
|
|
|
سونروتوكلاكس |
|
|
|
BTK CDAC |
|
|
|
Anti-LAG3 |
|
|
|
التطور المبكر
|
|
المراحل الرئيسية المتوقعة القادمة
أبرز النقاط
- الحصول على موافقة إدارة الغذاء والدواء الأمريكية على بروكينسا بالاقتران مع أوبينوتوزوماب لعلاج رطان الغدد الليمفاوية الجريبي المنتكس أو المقاوم، مما يجعله مثبط BTK ذا التصنيف الأوسع في تلك الفئة؛
- الحصول على موافقة إدارة الغذاء والدواء الأمريكية على عقار تيسليزوماب كمسار العلاج الأول والثاني لمرض سرطان الخلايا الحرشفية المريئي، مما يدل على التوسع العالمي في محفظة الأورام الصلبة المبتكرة
|
الفئة |
الأصل |
المراحل الرئيسية المتوقعة |
|
الموافقات التنظيمية المتوقعة |
بروكينسا |
|
|
تيسليزوماب |
|
|
|
التقديمات التنظيمية المتوقعة |
بروكينسا |
|
|
تيسليزوماب |
|
|
|
زانيداتاماب2 |
|
|
|
الأنشطة السريرية المتوقعة |
سونروتوكلاكس |
|
|
Ociperlimab |
|
|
|
Tarlatamab3 |
|
|
|
التطور المبكر |
|
|
|
1 بقيادتها للتعاون مع Biolabs؛ تتمتع BeiGene بحقوق تجارية باستثناء الصين |
||
|
2 بقيادتها للتعاون مع Jazz/Zymeworks؛ تتمتع BeiGene بحقوق تجارية في منطقة آسيا والمحيط الهادئ (باستثناء اليابان) وأستراليا ونيوزيلندا |
||
|
3 بقيادتها للتعاون مع Amgen؛ سيكون لدى BeiGene حقوق تجارية في الصين وعائدات متدرجة من رقم واحد على صافي المبيعات خارج الصين |
||
|
4 XmAb® هي علامة تجارية مسجلة لشركة .Xencor, Inc |
||
عمليات التصنيع
- اقتربنا من الانتهاء من إنشاء منشأة أمريكية رائدة لتصنيع المواد البيولوجية والبحث والتطوير السريري بقيمة 800 مليون دولار في مجمع برينستون ويست للابتكار في هوبويل بولاية نيوجيرسي، والذي من المتوقع أن يبدأ تشغيله في يوليو 2024؛ تحتوي المنشأة على أكثر من مليون قدم مربعة من إجمالي العقارات القابلة للتطوير، مما يسمح بالتوسع المستقبلي؛
- الانتهاء من البناء في الحرم الجامعي الجديد لتصنيع الجزيئات الصغيرة في سوتشو، بالصين. أضافت المرحلة الأولى من البناء أكثر من 559000 قدم مربعة ووسعت القدرة الإنتاجية إلى 1 مليار وحدة على شكل جرعة صلبة سنويًا؛
- تم الانتهاء من بناء منشأة إنتاج لاقتران الأجسام المضادة بالأدوية بمساحة 250,000 قدم مربعة وإمكانات إنتاج سريرية بيولوجية إضافية بمساحة 170,000 قدم مربعة في منشأتنا البيولوجية المتطورة في قوانغتشو، بالصين، مما يرفع السعة الإجمالية إلى 65,000 لتر.
تطورات الشركة
- حصلت على ترخيص عالمي حصري لمثبط CDK2 المتمايز من شركة .Ensem Therapeutics, Inc، مما يكمل خط التطوير المبكر للشركة في مجال سرطان الثدي والأورام الصلبة الأخرى.
|
الملخص المالي |
||||||||||||
|
تحديد بيانات الميزانية العمومية الموحدة المكثفة (مبادئ المحاسبة المقبولة عمومًا في الولايات المتحدة) |
||||||||||||
|
(المبالغ بآلاف الدولارات الأمريكية) |
||||||||||||
|
|
اعتبارًا من |
|||||||||||
|
|
31 ديسمبر، |
|
31 ديسمبر، |
|||||||||
|
|
|
2023 |
|
|
2022 |
|||||||
|
|
(مدققة) |
|||||||||||
|
الأصول: |
|
|
|
|||||||||
|
النقد وما يعادله والنقد المقيد والاستثمارات قصيرة الأجل |
$ |
3,188,584 |
|
$ |
4,540,288 |
|||||||
|
صافي حسابات القبض |
|
358,027 |
|
|
173,168 |
|||||||
|
صافي المخزونات |
|
416,122 |
|
|
282,346 |
|||||||
|
صافي العقارات والمصنع والمعدات |
|
1,324,154 |
|
|
845,946 |
|||||||
|
إجمالي الأصول |
$ |
5,805,275 |
|
$ |
6,379,290 |
|||||||
|
المطلوبات وحقوق المساهمين: |
|
|
|
|||||||||
|
حسابات الدفع |
$ |
315,111 |
|
$ |
294,781 |
|||||||
|
المصروفات المستحقة والذمم الدائنة الأخرى |
|
693,731 |
|
|
467,352 |
|||||||
|
الإيراد المؤجل |
|
300 |
|
|
255,887 |
|||||||
|
مسؤولية تقاسم تكاليف البحث والتطوير |
|
238,666 |
|
|
293,960 |
|||||||
|
الدين |
|
885,984 |
|
|
538,117 |
|||||||
|
إجمالي الالتزامات |
|
2,267,948 |
|
|
1,995,935 |
|||||||
|
إجمالي حقوق المساهمين |
$ |
3,537,327 |
|
$ |
4,383,355 |
|||||||
|
بيانات العمليات الموحدة المكثفة (مبادئ المحاسبة المقبولة عمومًا في الولايات المتحدة) |
||||||||||||
|
(المبالغ بآلاف الدولارات الأمريكية، باستثناء الأسهم وأسهم الإيداع الأمريكية (ADSs) لكل سهم وبيانات سهم الإيداع الأمريكي) |
||||||||||||
|
|
||||||||||||
|
|
ثلاثة أشهر منتهية 31 ديسمبر، |
|
اثنا عشر شهرًا منتهية 31 ديسمبر، |
|||||||||
|
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
|
|
(غير مدققة) |
|
(مدققة) |
|||||||||
|
الإيرادات |
|
|
|
|
|
|
|
|||||
|
صافي إيرادات المنتج |
$ |
630,526 |
|
$ |
339,022 |
|
$ |
2,189,852 |
|
$ |
1,254,612 |
|
|
إيرادات التعاون |
|
3,883 |
|
|
41,073 |
|
|
268,927 |
|
|
161,309 |
|
|
إجمالي الإيرادات |
|
634,409 |
|
|
380,095 |
|
|
2,458,779 |
|
|
1,415,921 |
|
|
تكلفة المبيعات – المنتجات |
|
105,832 |
|
|
73,522 |
|
|
379,920 |
|
|
286,475 |
|
|
الربح الكلي |
|
528,577 |
|
|
306,573 |
|
|
2,078,859 |
|
|
1,129,446 |
|
|
نفقات التشغيل |
|
|
|
|
|
|
|
|||||
|
البحث والتطوير |
|
493,987 |
|
|
446,023 |
|
|
1,778,594 |
|
|
1,640,508 |
|
|
البيع العام والإداري |
|
416,547 |
|
|
328,984 |
|
|
1,504,501 |
|
|
1,277,852 |
|
|
استهلاك الأصول غير الملموسة |
|
1,838 |
|
|
188 |
|
|
3,500 |
|
|
751 |
|
|
إجمالي نفقات التشغيل |
|
912,372 |
|
|
775,195 |
|
|
3,286,595 |
|
|
2,919,111 |
|
|
الخسارة من العمليات |
|
(383,795) |
|
|
(468,622) |
|
|
(1,207,736) |
|
|
(1,789,665) |
|
|
صافي إيرادات الفوائد |
|
16,274 |
|
|
18,219 |
|
|
74,009 |
|
|
52,480 |
|
|
صافي الإيرادات (مصروفات) الأخرى |
|
16,749 |
|
|
19,438 |
|
|
307,891 |
|
|
(223,852) |
|
|
الخسارة قبل ضرائب الدخل |
|
(350,772) |
|
|
(430,965) |
|
|
(825,836) |
|
|
(1,961,037) |
|
|
مصروفات ضريبة الدخل |
|
16,781 |
|
|
14,370 |
|
|
55,872 |
|
|
42,778 |
|
|
صافي الخسارة |
|
(367,553) |
|
|
(445,335) |
|
|
(881,708) |
|
|
(2,003,815) |
|
|
|
|
|
|
|
|
|
|
|||||
|
صافي الخسارة لكل سهم |
$ |
(0.27) |
|
$ |
(0.33) |
|
$ |
(0.65) |
|
$ |
(1.49) |
|
|
المتوسط المرجح للأسهم القائمة – الأساسية والمخففة |
|
1,353,005,058 |
|
|
1,348,916,108 |
|
|
1,357,034,547 |
|
|
1,340,729,572 |
|
|
|
|
|
|
|
|
|
|
|||||
|
صافي الخسارة لكل سهم إيداع أمريكي (“ADS“) |
$ |
(3.53) |
|
$ |
(4.29) |
|
$ |
(8.45) |
|
$ |
(19.43) |
|
|
المتوسط المرجح لأسهم الإيداع الأمريكية القائمة – الأساسية والمخففة |
|
104,077,312 |
|
|
103,762,778 |
|
|
104,387,273 |
|
|
103,133,044 |
|
ملاحظة بشأن استخدام التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا
توفر BeiGene بعض التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا، بما في ذلك نفقات التشغيل المعدلة وخسائر التشغيل المعدلة وبعض بنود بيان الدخل الأخرى غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا، والتي تتضمن كل منها تعديلات على أرقام مبادئ المحاسبة المقبولة عمومًا. تهدف هذه التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا إلى توفير معلومات إضافية عن الأداء التشغيلي لشركة BeiGene. لا تشمل التعديلات على أرقام المبادئ المحاسبية المقبولة عمومًا لشركة BeiGene، حسب الاقتضاء، البنود غير النقدية مثل التعويض القائم على الأسهم والإهلاك والاستهلاك. يمكن أيضًا تضمين بعض العناصر الخاصة الأخرى أو الأحداث الموضوعية في التسويات غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا بشكل دوري عندما يكون حجمها كبيرًا خلال الفترات المتكبدة. تحتفظ BeiGene بسياسة راسخة غير متوافقة مع مبادئ المحاسبة المقبولة عمومًا والتي توجه تحديد التكاليف التي سيتم استبعادها في التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا والبروتوكولات والضوابط والموافقة ذات الصلة في ما يتعلق باستخدام هذه التدابير. تعتقد BeiGene أن هذه التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا، عند النظر إليها مع أرقام مبادئ المحاسبة المقبولة عمومًا، يمكن أن تعزز الفهم العام للأداء التشغيلي لشركة BeiGene. يتم تضمين التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا بقصد تزويد المستثمرين بفهم أكثر اكتمالاً للنتائج والاتجاهات المالية التاريخية والمتوقعة للشركة وتسهيل المقارنات بين الفترات وفي ما يتعلق بالمعلومات المتوقعة. بالإضافة إلى ذلك، فإن هذه التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا هي من بين المؤشرات التي تستخدمها إدارة BeiGene لأغراض التخطيط والتنبؤ وقياس أداء الشركة. يجب النظر في هذه التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا بالإضافة إلى التدابير المالية المحسوبة المتوافقة مع مبادئ المحاسبة المقبولة عمومًا وليس كبديل عنها أو أعلى منها. يمكن حساب التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا التي تستخدمها الشركة بشكل مختلف عن التدابير المالية غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا التي تستخدمها الشركات الأخرى، وبالتالي قد لا تكون قابلة للمقارنة معها.
|
|
||||||||||||
|
التوفيق بين التدابير المختارة لمبادئ المحاسبة المقبولة عمومًا والتدابير غير المتوافقة مع مبادئ المحاسبة المقبولة عمومًا |
||||||||||||
|
(بالآلاف، باستثناء مبالغ السهم) |
||||||||||||
|
(غير مدققة) |
||||||||||||
|
|
||||||||||||
|
|
|
ثلاثة أشهر تنتهي في 31 ديسمبر، |
|
اثنا عشر شهرًا تنتهي في 31 ديسمبر، |
||||||||
|
|
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
مطابقة مبادئ المحاسبة المقبولة عمومًا مع تكلفة المبيعات المعدلة – المنتجات: |
|
|
|
|
|
|
|
|
||||
|
تكلفة المبيعات وفقًا للمبادئ المحاسبية المقبولة عمومًا – المنتجات |
|
$ |
105,832 |
|
$ |
73,522 |
|
$ |
379,920 |
|
$ |
286,475 |
|
أقل: الإهلاك |
|
|
1,898 |
|
|
— |
|
|
8,578 |
|
|
— |
|
أقل: استهلاك الأصول غير الملموسة |
|
|
1,119 |
|
|
781 |
|
|
3,739 |
|
|
3,225 |
|
التكلفة المعدلة للمبيعات – المنتجات |
|
$ |
102,815 |
|
$ |
72,741 |
|
$ |
367,603 |
|
$ |
283,250 |
|
|
|
|
|
|
|
|
|
|
||||
|
التوفيق بين مبادئ المحاسبة المقبولة عمومًا والبحث والتطوير المعدل: |
|
|
|
|
|
|
|
|
||||
|
البحث والتطوير المتوافق مع مبادئ المحاسبة المقبولة عمومًا |
|
$ |
493,987 |
|
$ |
446,023 |
|
$ |
1,778,594 |
|
$ |
1,640,508 |
|
أقل: مصاريف التعويض على أساس الأسهم |
|
|
39,424 |
|
|
34,966 |
|
|
163,550 |
|
|
139,348 |
|
أقل: الإهلاك |
|
|
17,180 |
|
|
6,871 |
|
|
56,084 |
|
|
26,241 |
|
البحث والتطوير المعدلان |
|
$ |
437,383 |
|
$ |
404,186 |
|
$ |
1,558,960 |
|
$ |
1,474,919 |
|
|
|
|
|
|
|
|
|
|
||||
|
مطابقة مبادئ المحاسبة المقبولة عمومًا للمبيعات المعدلة العامة والإدارية: |
|
|
|
|
|
|
|
|
||||
|
مبادئ المحاسبة المقبولة عمومًا والمتعلقة بالمبيعات العامة والإدارية |
|
$ |
416,547 |
|
$ |
328,984 |
|
$ |
1,504,501 |
|
$ |
1,277,852 |
|
أقل: مصاريف التعويض على أساس الأسهم |
|
|
53,328 |
|
|
43,160 |
|
|
204,038 |
|
|
163,814 |
|
أقل: الإهلاك |
|
|
1,784 |
|
|
10,176 |
|
|
15,774 |
|
|
36,061 |
|
المبيعات المعدلة، العامة والإدارية |
|
$ |
361,435 |
|
$ |
275,648 |
|
$ |
1,284,689 |
|
$ |
1,077,977 |
|
|
|
|
|
|
|
|
|
|
||||
|
مطابقة مبادئ المحاسبة المقبولة عمومًا مع نفقات التشغيل المعدلة |
|
|
|
|
|
|
|
|
||||
|
نفقات التشغيل المتوافقة مع مبادئ المحاسبة المقبولة عمومًا |
|
|
912,372 |
|
|
775,195 |
|
|
3,286,595 |
|
|
2,919,111 |
|
أقل: مصاريف التعويض على أساس الأسهم |
|
|
92,752 |
|
|
78,126 |
|
|
367,588 |
|
|
303,162 |
|
أقل: الإهلاك |
|
|
18,964 |
|
|
17,047 |
|
|
71,858 |
|
|
62,302 |
|
أقل: استهلاك الأصول غير الملموسة |
|
|
1,838 |
|
|
188 |
|
|
3,500 |
|
|
751 |
|
نفقات التشغيل المعدلة |
|
$ |
798,818 |
|
$ |
679,834 |
|
$ |
2,843,649 |
|
$ |
2,552,896 |
|
|
|
|
|
|
|
|
|
|
||||
|
مطابقة مبادئ المحاسبة المقبولة عمومًا مع الخسارة المعدلة من العمليات: |
|
|
|
|
|
|
|
|
||||
|
الخسارة المتوافقة مع مبادئ المحاسبة المقبولة عمومًا من العمليات |
|
$ |
(383,795) |
|
$ |
(468,622) |
|
$ |
(1,207,736) |
|
$ |
(1,789,665) |
|
بالإضافة إلى: مصاريف التعويض على أساس الأسهم |
|
|
92,752 |
|
|
78,126 |
|
|
367,588 |
|
|
303,162 |
|
بالإضافة إلى: الإهلاك |
|
|
20,862 |
|
|
17,047 |
|
|
80,436 |
|
|
62,302 |
|
بالإضافة إلى: استهلاك الأصول غير الملموسة |
|
|
2,957 |
|
|
969 |
|
|
7,239 |
|
|
3,976 |
|
الخسارة المعدلة من العمليات |
|
$ |
(267,224) |
|
$ |
(372,480) |
|
$ |
(752,473) |
|
$ |
(1,420,225) |
|
|
|
|
|
|
|
|
|
|
||||
ترجى ملاحظة أن الأرقام الواردة أعلاه قد لا يكون مجموعها دقيقًا بسبب التقريب
حول BeiGene
BeiGene هي شركة عالمية متخصصة في علاج الأورام تعمل على اكتشاف وتطوير علاجات مبتكرة تكون ميسورة التكلفة ومتاحة لمرضى السرطان في جميع أنحاء العالم. من خلال محفظة واسعة، نقوم بتسريع تطوير خط إنتاجنا المتنوع من العلاجات الجديدة من خلال قدراتنا الداخلية وتعاوننا. نحن ملتزمون بتحسين الوصول إلى الأدوية بشكل جذري لعدد أكبر بكثير من المرضى الذين يحتاجون إليها. يمتد فريقنا العالمي المتنامي الذي يضم أكثر من 10,000 زميل في خمس قارات، مع مكاتب إدارية في بازل وبكين وكامبريدج بالولايات المتحدة. لمعرفة المزيد عن BeiGene، ترجى زيارة www.beigene.com ومتابعتنا على LinkedIn وX (المعروف سابقًا باسم Twitter).
البيانات التطلعية
يحتوي هذا البيان الصحفي على بيانات تطلعية بالمعنى المقصود في قانون إصلاح التقاضي للأوراق المالية الخاصة لعام 1995 وقوانين الأوراق المالية الفيدرالية الأخرى، بما في ذلك البيانات المتعلقة بتقدم BeiGene نحو أن تصبح شركة مبتكرة ومؤثرة في علم الأورام من الجيل التالي؛ ومستقبل خط إنتاج BeiGene لعلاجات الأورام؛ وقدرة BeiGene على زيادة الإيرادات عبر المناطق الجغرافية الجديدة والحالية، لا سيما في الولايات المتحدة؛ والقدرات المتوقعة وتواريخ الانتهاء لمرافق التصنيع التابعة للشركة قيد الإنشاء وإمكانية زيادة هذه المرافق لقدرات التصنيع؛ والموافقات التنظيمية المتوقعة من BeiGene وتقديمها وأنشطتها السريرية؛ وخطط BeiGene والتزاماتها وتطلعاتها وأهدافها تحت عنوان “حول BeiGene“. قد تختلف النتائج الفعلية ماديًا عن تلك المشار إليها في البيانات التطلعية نتيجة لعوامل مهمة مختلفة، بما في ذلك قدرة BeiGene على إثبات فعالية وسلامة الأدوية المرشحة لها؛ والنتائج السريرية للأدوية المرشحة، والتي قد لا تدعم المزيد من التطوير أو الموافقة على التسويق؛ وإجراءات الهيئات التنظيمية، والتي قد تؤثر على بدء وتوقيت وتقدم التجارب السريرية والموافقة على التسويق؛ وقدرة BeiGene على تحقيق النجاح التجاري للأدوية المسوقة والأدوية المرشحة، وفي حالة الموافقة عليها؛ قدرة BeiGene على الحصول على حماية الملكية الفكرية لأدويتها وتقنياتها والحفاظ عليها؛ واعتماد BeiGene على أطراف ثالثة لإجراء تطوير الأدوية وتصنيعها وتسويقها وخدمات أخرى؛ وخبرة BeiGene المحدودة في الحصول على الموافقات التنظيمية وتسويق المنتجات الصيدلانية وقدرة BeiGene على الحصول على تمويل إضافي للعمليات واستكمال تطوير مرشحيها للأدوية وتحقيق الربحية والحفاظ عليها؛ وتمت مناقشة تلك المخاطر بشكل أكثر تفصيلاً في القسم المعنون “عوامل الخطر” في أحدث تقرير سنوي لشركة BeiGene بشأن النموذج 10-K، بالإضافة إلى مناقشات المخاطر المحتملة والشكوك والعوامل المهمة الأخرى في إيداعات BeiGene اللاحقة لدى هيئة الأوراق المالية والبورصات الأمريكية. جميع المعلومات الواردة في هذا البيان الصحفي اعتبارًا من تاريخ هذا البيان الصحفي، ولا تتعهد BeiGene بتحديث هذه المعلومات ما لم يقتض القانون ذلك.
IMBRUVICA® هي علامة تجارية مسجلة لشركة .Pharmacyclics LLC
صور / وسائط متعددة متوفرة على : https://www.businesswire.com/news/home/53900859/en
إن نص اللغة الأصلية لهذا البيان هو النسخة الرسمية المعتمدة. أما الترجمة فقد قدمت للمساعدة فقط، ويجب الرجوع لنص اللغة الأصلية الذي يمثل النسخة الوحيدة ذات التأثير القانوني.
Contacts
جهة اتصال المستثمر
Liza Heapes
+1 857-302-5663
ir@beigene.com
الاتصال الإعلامي
Kyle Blankenship
+1 667-351-5176
media@beigene.com